Síndrome de Down

A Síndrome de Down foi descrita em 1866 por John Langdon Down. Este médico inglês descreveu as características da Síndrome, que acabou sendo batizada com o seu nome, foi apelidada pejorativamente de mongolismo pela semelhança na aparência existente entre os portadores e o povo mongol, pela conscientização da população este termo não é mais usado. Em 1959, Jerôme Lejeune descobriu que a causa da Síndrome de Down era genética, pois até então a literatura relatava apenas as características que indicavam a Síndrome.
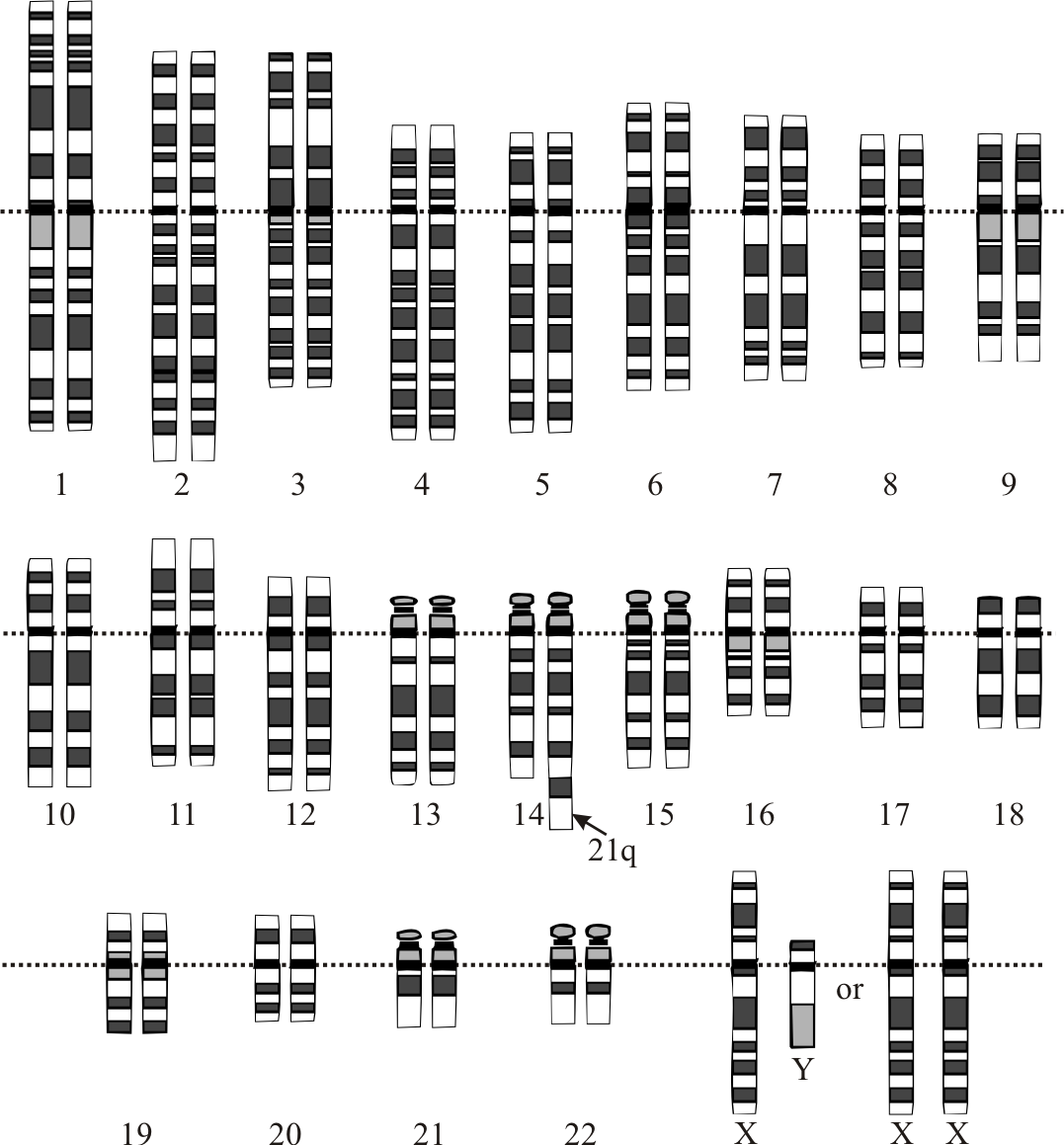
A Síndrome de Down é um acidente genético, que ocorre ao acaso durante a divisão celular do embrião. Esta alteração genética pode ser apresentar de 3 formas:
Trissomia simples (padrão):
Nestes casos os pacientes apresentam em todas as suas células 47 cromossomos e não 46, e o cromossomo extra é do par 21. Ocorre por acidente genético e em mais de 80% dos casos se deve a uma não disjunção cromossômica na meiose materna. O fator de risco conhecido que mais se associa a este acidente é a idade materna elevada (idade maior que 35 anos). No entanto, como o número de mulheres jovens que têm filhos é muito maior, a maioria dos pacientes Down com trissomia livre são filhos de mães jovens. Como se deve a um acidente genético, não é familiar e o risco de recorrência em casais é de 1 a 2% (um a dois por cento).
Translocação:
O cromossomo extra do par 21 fica aderido em outro cromossomo. Nesse caso embora indivíduo tenha 46 cromossomos, ele é portador da Síndrome de Down. Os cromossomos que mais frequentemente se encontram aderidos ao cromossomo 21 nos casos de translocação são os acrocêntricos: 13, 14, 15, o próprio 21 e o 22). Assim, trata-se de uma trissomia parcial e não de uma trissomia completa, este cariótipo é encontrado em aproximadamente 5% dos casos de Síndrome de Down.
É importante descobrir se uma criança tem Síndrome de Down por translocação, pois em aproximadamente um terço dos casos um dos pais é portador. Embora este pai e esta mãe sejam perfeitamente normais tanto física quanto mentalmente, pode haver um risco maior de terem filhos com Síndrome de Down. Estes pais necessitam de um aconselhamento genético específico.
Mosáico:
Cariótipo: 46XX/47XX ou 46XY/47XY (+21)
A alteração genética compromete apenas parte das células, ou seja, algumas células são trissômicas ( têm 47cromossomos) e outras normais (46 cromossomos). Ocorre em cerca de 2% dos casos de Síndrome de Down. Os casos de mosaicismo podem originar-se da não disjunção mitótica nas primeiras divisões de um zigoto normal.
Diagnóstico pré-natal:
O diagnóstico pré-natal permite, durante a gravidez, saber se o feto é ou não acometido pela Síndrome de Down.
As principais indicações para o diagnóstico pré-natal são:
1. Idade materna acima de 35 anos.
2. Filho anterior com Síndrome de Down.
3. Um dos pais portador de translocação cromossômica envolvendo o cromossomo 21.
4. Malformações fetais diagnosticadas pelo ultra-som.
5. Testes de triagem pré-natal alterados.
Os três métodos utilizados são os seguintes:
1. Coleta de vilosidades coriônicas (após 9 semanas de gravidez): Trata-se duma biópsia transvaginal. Relativamente à amniocentese, tem como vantagem a detecção mais precoce das anomalias cromossômicas, mas está associada a uma taxa maior de abortos (2-5%).
As principais indicações para o diagnóstico pré-natal são:
1. Idade materna acima de 35 anos.
2. Filho anterior com Síndrome de Down.
3. Um dos pais portador de translocação cromossômica envolvendo o cromossomo 21.
4. Malformações fetais diagnosticadas pelo ultra-som.
5. Testes de triagem pré-natal alterados.
Os três métodos utilizados são os seguintes:
1. Coleta de vilosidades coriônicas (após 9 semanas de gravidez): Trata-se duma biópsia transvaginal. Relativamente à amniocentese, tem como vantagem a detecção mais precoce das anomalias cromossômicas, mas está associada a uma taxa maior de abortos (2-5%).
2. Amniocentese (após 14 semanas de gravidez): É o método mais usado na detecção de trissomia 21 nas gravidezes de “alto risco”. É feito retirando-se uma pequena quantidade de líquido amniótico.
3. Cordocentese (após 18 semanas de gravidez): método invasivo no qual uma amostra do sangue fetal é obtida através da punção do cordão umbilical guiada por ultra-som por via abdominal materna.
Testes de triagem - Screening pré-natal:
São testes não invasivos que permitem suspeitar que determinada gravidez, não incluída nas indicações de diagnóstico pré-natal, possa resultar em um recém-nascido com Síndrome de Down.
Os mais utilizados são as dosagens de alfa-fetoproteina, estriol não conjugado e gonadotrofina coriônica no soro materno, denominado tri-teste, e a medida da translucência nucal.
É importante lembrar que um teste de triagem alterado não significa diagnóstico de Síndrome de Down no feto. Eles são apenas marcadores de risco e quando alterados, está indicado o diagnóstico pré-natal pelas técnicas tradicionais.
Os mais utilizados são as dosagens de alfa-fetoproteina, estriol não conjugado e gonadotrofina coriônica no soro materno, denominado tri-teste, e a medida da translucência nucal.
É importante lembrar que um teste de triagem alterado não significa diagnóstico de Síndrome de Down no feto. Eles são apenas marcadores de risco e quando alterados, está indicado o diagnóstico pré-natal pelas técnicas tradicionais.
Diagnóstico pós-natal:
O diagnóstico da Síndrome de Down é estabelecido com base em uma série de sinais e sintomas, sendo posteriormente confirmado pela análise do cariótipo, realizado a partir do exame dos leucócitos obtidos de uma pequena amostra de sangue periférico. Somente este exame é que realmente comprova o cromossoma extra com um número total de 47, como resultante de uma trissomia do cromossomo 21.
É importante salientar os seguintes aspectos:
1. Geralmente o paciente com Síndrome de Down apresenta diversas destas características, mas algumas vezes ele apresenta somente poucas delas.
2. Nenhuma delas é essencial e/ou suficiente para o diagnóstico.
3. Nenhuma criança tem todos os sinais e nenhum sinal isolado é patognomônico.
O diagnóstico da Síndrome de Down é estabelecido com base em uma série de sinais e sintomas, sendo posteriormente confirmado pela análise do cariótipo, realizado a partir do exame dos leucócitos obtidos de uma pequena amostra de sangue periférico. Somente este exame é que realmente comprova o cromossoma extra com um número total de 47, como resultante de uma trissomia do cromossomo 21.
É importante salientar os seguintes aspectos:
1. Geralmente o paciente com Síndrome de Down apresenta diversas destas características, mas algumas vezes ele apresenta somente poucas delas.
2. Nenhuma delas é essencial e/ou suficiente para o diagnóstico.
3. Nenhuma criança tem todos os sinais e nenhum sinal isolado é patognomônico.
Características dos portadores:
o Retardo mental de leve (QI 50-70) a moderado (QI 35-50), com os escores do QI de crianças possuindo síndrome de Down do tipo mosaico tipicamente 10-30 pontos maiores;
o Parte posterior da cabeça levemente achatada (braquicefalia) na maioria das crianças, dando aparência arredondada à cabeça. As moleiras (fontanela) são, muitas vezes, maiores e demoram mais para se fechar. Na linha média onde os ossos do crânio se encontram (linha de sutura), há muitas vezes, uma moleira adicional (fontanela falsa). Cabelo liso e fino, em algumas crianças, pode haver áreas com falhas de cabelo (alopecia parcial), ou, em casos raros, todo o cabelo pode ter caído (alopecia total);
o Microcefalia, um reduzido peso e tamanho do cérebro;
o Rosto com contorno achatado, devido, principalmente, aos ossos faciais pouco desenvolvidos e nariz pequeno. Osso nasal geralmente afundado. Em muitas crianças, passagens nasais estreitadas;
o Pálpebras estreitas e levemente oblíquas (a prega epicântica - semelhante aos orientais;
o Orelhas pequenas e de implantação baixa, a borda superior da orelha ( hélix ) é muitas vezes dobrada. A estrutura da orelha é ocasionalmente, alterada. Os canais do ouvido são estreitos;
o Boca pequena. Algumas crianças mantêm a boca aberta e a língua pode projetar-se um pouco, língua protrusa (devido à pequena cavidade oral). À medida que a criança com síndrome de Down fica mais velha, a língua pode ficar com estrias. O céu da boca (palato) é mais estreito do que na criança "normal". A erupção dos dentes de leite é geralmente atrasada. Às vezes um ou mais dentes estão ausentes e alguns dentes podem ter um formato um pouco diferente. Mandíbulas pequenas, o que leva, muitas vezes, a sobreposição dos dentes.;
o Pescoço de aparência larga e grossa com pele redundante na nuca, dobras soltas de pele são observadas, muitas vezes, em ambos os lados da parte posterior do pescoço, os quais se tornam menos evidentes, podendo desaparecer, à medida que a criança cresce;
o Abdômen saliente e tecido adiposo abundante. Tórax com formato estranho, sendo que a criança pode apresentar um osso peitoral afundado (tórax afunilado) ou o osso peitoral pode estar projetado (peito de pomba). Na criança cujo coração é aumentado devido à doença cardíaca congênita, o peito pode parecer mais globoso do lado do coração. Em conseqüência das anomalias cardíacas e de uma baixa resistência às infecções, a longevidade dos portadores costuma ser reduzida;
o Mãos e pés pequenos e grossos, dedos dos pés geralmente curtos e o quinto dedo muitas vezes levemente curvado para dentro (clinodactilia de quintos dedos), falta de uma falange no dedo mínimo. Prega única nas palmas (prega simiesca). Na maioria das crianças, há um espaço grande entre o dedão e o segundo dedo, com uma dobra entre eles na sola do pé, enfraquecimento geral dos ligamentos articulares;
o Genitálias pouco desenvolvidas; nos homens o pênis é pequeno e há criptorquidismo (testículo retido no abdômen), nas mulheres os lábios e o clitóris são pouco desenvolvidos. Os meninos são estéreis, e as meninas ovulam, embora os períodos não sejam regulares;
o Hipotonia muscular e hiperflexibilidade nas articulações;
o Manchas de Brushfield (pequenos pontos brancos presentes na periferia da íris do olho humano devido a uma agregação de um elemento normal da íris.
Freqüentemente estas crianças apresentam mal-formações em órgãos desde seu nascimento:
- As principais são doenças congênitas do coração, atingindo 30% dos portadores de síndrome de Down;
- Mal-formações do trato gastrointestinal, como estenose ou atresia do duodeno, imperfuração anal, e doença de Hirschsprung;
- Perda auditiva condutiva;
- Problemas de visão (miopia, astigmatismo ou estrabismo)
- Alguns tipos de leucemia têm maior incidência crianças com síndrome de Down;
- Pessoas com síndrome de Down desenvolvem as características neuropatológicas da doença de Alzheimer em uma idade muito mais precoce.
Síndrome de Patau
Em 1956 o dinamarquês Thomas Bartholin descreveu o quadro clínco de crianças que apresentavam esta anomalia, mas foi somente em 1960 que Klaus Patau descreveu a síndrome, observando um caso de mal formações múltiplas em um neonato trissômico para o cromossomo 13.
A trissomia do cromossomo 13 tem como definição uma desordem cromossomal resultando em uma síndrome caracterizada especificamente pôr anomalias morfológicas e malformação de órgãos, gerando a inviabilidade dos afetados.
Tem como principal causa a não disjunção dos cromossomos durante a anáfase 1 da meiose, gerando gametas com 24 cromátides. Neste caso, um gameta possui um par de cromossomos 13, que juntando com o cromossomo 13 do gameta do parceiro forma um ovo com trissomia. Cerca de 20% dos casos resultam de uma translocação não-balanceada.
Assim como a maioria das outras trissomias, associa-se à idade materna avançada (>37 anos), essa correlação é feita, pois mulheres acima dessa idade estão mais propícias a ocorrência da não disjunção dos cromossomos em seus óvulos. Já que, a mulher matura apenas um ovócito por vez (por ciclo/mês) enquanto o homem matura milhões de espermatozóides por dia. Portanto quando um espermatozóide apresenta alguma alteração, como alteração numérica, ele tem chances mínimas de fecundar um óvulo. Logo, um espermatozóide normal sempre terá mais chances de fecundar um óvulo do que um espermatozóide com alguma alteração.
Sua incidência foi estimada em cerca de 1 caso para 6000 nascimentos. Aproximadamente 45% dos afetados falecem após 1 mês de vida; 70%, aos 6 meses e somente menos de 5% dos casos sobrevivem mais de 3 anos. A maior sobrevida relatada na literatura foi a de 10 anos de idade.
Com frequência os fetos portadores da trissonomia 13 não chegam a ser concebidos, apenas 2,5% dos fetos com síndrome de Patau nascem vivos. A maioria das mortes intrauterinas ocorre precocemente na gravidez, sendo a sobrevivência até o trimestre de apenas 5%. Devido a isto, os casos da síndrome de Patau são mais frequentes em abortos espontâneos, representando deste modo 1% dos abortos reconhecidos.
Fatores de Risco
- Idade materna avançada;
- Filho com fenótipo anormal;
- Retardo do crescimento intra-uterino;
-Abortos prévios.
Características dos portadores:
-Malformações graves do sistema nervoso central como arrinencefalia e holoprosencefalia malformações cerebelares, heterotopias, hipoplasia do trato piramidal, defeitos do tubo neural, hidrocefalia, meningomielocele e microcefalia. Um retardamento mental acentuado está presente;
-Malformações cardíacas (80%): defeito de septo ventricular, dextrocardia e valvas semilunares bicúspides;
- Malformações Genitourinárias: útero bicornado, criptorquidia, anormalidades do saco escrotal, ovários hipoplásticos e rins policísticos;
- Malformações faciais como fendas palatinas e lábios leporinos, fronte oblíqua, hipertelorismo ocular e microftalmia bilateral, podendo chegar a anoftalmia, coloboma da íris, olhos pequenos, extremamente afastados ou até ausentes, orelhas malformadas e baixamente implantadas, com surdez aparente, microcefalia;
- Malformações de membros: polidactilia (60-80%) e/ou sindactilia, punhos cerrados e plantas arqueadas;
- Malformações gastrointestinais: anormalidades da lobulação do fígado, hiperplasia pancreática;
- Malformações dermatológicas: anormalidades no couro cabeludo, hemangiomas faciais, aplasia de pele
- Alterações funcionais: crises epilépticas, hipotonia ou hipertonia, apnéia central, hidronefrose e hidroureter frequentemente achatados, anormalidades no controle da respiração e infecções respiratórias, hérnias, etc;
O fenótipo da Síndrome de Patau pode se originar de três formas:
-Trissomia simples do 13:
Cariótipo: 47XX(+13) ou 47XY(+13).
Ocorre devido à não-disjunção do cromossomo 13 durante a anáfase 1 da meiose materna, atinge aproximadamente 75% dos casos.
- Translocação Robertsoniana:
Cariótipo: 46XX (t ...;13) ou 46XY (t ...;13).
Sendo que ¾ das translocações são esporádicas, e ¼ são herdadas, responsáveis por aproximadamente 20% dos casos. As translocações familiares balanceadas ou não envolvendo cromossomos do grupo D estão entre as mais comuns, dentre as variações da síndrome. As pessoas normais que tem essa translocação equilibrada estão sob o risco de 5% não apenas de gerar uma criança com síndrome de Patau, mas também de ter em sua prole crianças com síndrome de Down por um efeito intercromossômico. Ocorrem quando dois cromossomos acrocêntricos (13, 14, 15, 21 e 22) perdem seus braços curtos e se unem próximo à região centromérica, formando um único cromossomo derivado. Pode ser monocêntrica ou pseudodicêntrica, dependendo do ponto de quebra dos cromossomos acrocêntricos. Apesar de resultar em um individuo com 45 cromossomos, não há alterações fenotípicas, pois os braços curtos em geral são genes de RNA ribossomal em múltiplas cópias. Mas existe o risco de formar gametas não equilibrados (segregações adjacente 1 e 2) e, como conseqüência, a geração de crianças com alterações genotípicas e fenotípicas. Como exemplo, um genitor portador de translocação robertsoniana (13q;14q) pode gerar uma criança com Síndrome de Patau.

Gametas de portador de translocação robnertsoniana equilibrada:
Cariótipo: 46XX/47XX ou 46XY/47XY (+13).
 Verificado pelo fato do afetado não possuir a anomalia cromossômica de forma detectável. . Esta alteração pode propiciar que o afetado chegue até a idade adulta, mesmo manifestando o fenótipo. Representa 5% das ocorrências da Síndrome. A alteração genética compromete apenas parte das células, ou seja, algumas células são trissômicas (têm 47 cromossomos) e outras normais (46 cromossomos). Os casos de mosaicismo podem originar-se da não disjunção mitótica nas primeiras divisões de um zigoto normal.
Verificado pelo fato do afetado não possuir a anomalia cromossômica de forma detectável. . Esta alteração pode propiciar que o afetado chegue até a idade adulta, mesmo manifestando o fenótipo. Representa 5% das ocorrências da Síndrome. A alteração genética compromete apenas parte das células, ou seja, algumas células são trissômicas (têm 47 cromossomos) e outras normais (46 cromossomos). Os casos de mosaicismo podem originar-se da não disjunção mitótica nas primeiras divisões de um zigoto normal.Diagnóstico Pré-Natal:
- Testes de Screening _ testes sorológicos São testes não invasivos que permitem suspeitar que determinada gravidez, não incluída nas indicações de diagnóstico pré-natal, possa resultar em um recém-nascido com a Síndrome.
Os mais utilizados são as dosagens de alfa-fetoproteina, estriol não conjugado e gonadotrofina coriônica no soro materno, denominado tri-teste, e a medida da translucência nucal.
É importante lembrar que um teste de triagem alterado não significa diagnóstico de Síndrome no feto. Eles são apenas marcadores de risco e quando alterados, está indicado o diagnóstico pré-natal pelas técnicas tradicionais.
Os mais utilizados são as dosagens de alfa-fetoproteina, estriol não conjugado e gonadotrofina coriônica no soro materno, denominado tri-teste, e a medida da translucência nucal.
É importante lembrar que um teste de triagem alterado não significa diagnóstico de Síndrome no feto. Eles são apenas marcadores de risco e quando alterados, está indicado o diagnóstico pré-natal pelas técnicas tradicionais.
-Ultra-sonografia.
-Amniocentese (após 14 semanas de gravidez): É o método mais usado na detecção de trissomia 21 nas gravidezes de “alto risco”. É feito retirando-se uma pequena quantidade de líquido amniótico.
-Punção de Vilosidade Coriônica (após 9 semanas de gravidez): Trata-se duma biópsia transvaginal. Relativamente à amniocentese, tem como vantagem a detecção mais precoce das anomalias cromossômicas, mas está associada a uma taxa maior de abortos (2-5%).
-Cordocentese (após 18 semanas de gravidez): método invasivo no qual uma amostra do sangue fetal é obtida através da punção do cordão umbilical guiada por ultra-som por via abdominal materna.
vídeo relacionado
vídeo relacionado
Síndrome de Klinefelter
Classificação e recursos externos | |
47,XXY | |
A síndrome de Klinefelter, descrita pela primeira vez por Harry Klinefelter em 1942, é a causa mais frequente de hipogonadismo e infertilidade em indivíduos do sexo masculino. A causa genética da síndrome foi descoberta em 1959, por P. A. Jacobs e J. A. Strong.
Ao estudar este caso, o Dr. Klinefelter relatou nos seu exames infertilidade, liberação de hormônio Gonadotropina (GnRH), um elevado nível de liberação de Hormônio Folículo Estimulante (FSH) e Hormônio Luteneizante (LH).
Com estes resultados foi publicado no Jornal de Metabolismo e Endocrinologia Clínica (1942), um artigo intitulado “Síndrome caracterizada por Ginecomastia, aspermatogênese e aumento da excreção de Hormônio Folículo Estimulante”, tendo como autores, Klinefelter H G, Reifestein E C Jr., e Albright F.
Desde então, a literatura só chama esta condição de síndrome de Klinefelter (SK).
As pessoas com síndrome de Klinefelter, do sexo masculino, têm um cromossomo X adicional (47, XXY), estatura elevada, algum desenvolvimento do tecido mamário e testículos pequenos. Também é possível encontrar pessoas com outros cariótipos, como 48, XXXY, 48, XXYY ou 49, XXXXY.
Metade dos casos resulta de erros na meiose I paterna, um terço de erros na meiose I materna e os demais de erros na meiose II ou de um erro mitótico pós-zigótico levando a mosaico. A idade da mãe é elevada nos casos associados a erros na meiose I materna, mas não nos outros casos (JACOBS et al., 1988).
Até 1960 o diagnóstico era feito através de exame histológico dos testículos que, mesmo após a puberdade, revelava ausência de células germinativas nos canais seminíferos. Atualmente a identificação dos Klinefelter é assegurada pelo cariótipo e pela pesquisa da cromatina sexual, através de um exame feito com uma amostra de sangue.
As estatísticas mostram que a cada 500 nascimentos é encontrado um menino com a síndrome.
Cariótipo
Evolução e sintomas
É de esperar que indivíduos com a síndrome de Klinefelter tenham uma esperança média de vida normal, no entanto há a referir um aumento considerável de acidentes vasculares cerebrais (6 vezes superior à população geral), assim como na incidência do câncer (1,6%). O atraso da linguagem (51%), o atraso motor (27%) e problemas escolares (44%) complicam o desenvolvimento destas crianças e em alguns estudos estão descritos comportamentos anti-sociais e psiquiátricos. Outros apontam para uma boa adaptação social e no trabalho.
Outra complicação é o défice auditivo, no entanto não está descrito um aumento da frequência de infecções respiratórias na infância, ao contrário das doenças auto-imunes (diabetes mellitus; doenças do colagéneo)
Tratamento e prevenção das complicações
Tecido mamário em homem com a Síndrome de Klinefelter.
Esta síndrome raramente é diagnosticada no recém-nascido face à ausência de sinais específicos. O diagnóstico precoce permite a intervenção antecipada, seja ela psicológica ou farmacológica. O rastreio de problemas visuais e auditivos, assim como a avaliação do desenvolvimento, devem ser realizados periodicamente. As anomalias constatadas devem ser seguidas em consultas de especialidade.
Muitas vezes detecta-se a anomalia apenas quando problemas comportamentais, desenvolvimento pubertal anómalo ou infertilidade aparecem. A puberdade apresenta problemas particulares secundários aos problemas genitais já referidos. Para uma melhor resposta, o tratamento com testosterona deve ser iniciado pelos 11-12 anos de idade. Está demonstrada a sua eficácia numa percentagem importante dos indivíduos, tanto em aspectos psicossociais como físicos. Por estes motivos estas crianças e adultos jovens devem ser acompanhados numa consulta de endocrinologia.
Esta anomalia genética está associada à idade materna avançada. Num casal com um filho com a síndrome de Klinefelter, o risco de recorrência é igual ou inferior a 1%. O estudo familiar é habitualmente desnecessário, salvo em raras situações. Nem sempre a infertilidade é a regra. Caso se encontrem indivíduos férteis, deve ser oferecido o diagnóstico pré-natal a fim de excluir alterações cromossómicas uma vez que existe um risco acrescido da mesma.
Síndrome de Edwars
Cariótipo:
A síndrome de Edwards ou trissomia 18, é uma síndrome genética resultante de trissomia do cromossomo 18. Ela foi descrita em 1960 pelo geneticista britânico John H. Edwards.
Sua frequencia varia entre 1:6.000 a 1:8.000 nascimentos. sendo que nascem mais meninas afetadas do que meninos Cerca de 95% dos embriões portadores da trissomia 18 evoluem para aborto espontâneo ou óbito fetal, nascendo apenas 5%. A mortalidade pós-natal da trissomia 18 é elevada, tendo estes recém-nascidos uma sobrevida média inferior a uma semana; globalmente, menos de 5% destas crianças atingem o primeiro ano de vida.Porém, apesar da esperança de vida para as crianças com síndrome de Edwards ser baixa, já foram registrados casos de adolescentes com 15 anos portadores da síndrome.
A maioria dos pacientes (95%) com a trissomia do cromossomo 18 apresenta trissomia simples (cariótipo 47, XX ou XY, +18), ocasionada pela não disjunção do cromossomo 18 no momento da formação do gameta (meiose), geralmente de origem materna. Entre os restantes, cerca de metade é constituído por casos de mosaicismo (46XX/47XX ou 46XY/47XY (+18), com uma expressão variável mas geralmente mais leve, e outro tanto por situações mais complexas, como aneuploidias duplas ou translocações (46XX (t ...;18) ou 46XY (t ...;18) ), envolvendo todo ou a maior parte do cromossomo 18, , o qual pode ser herdado ou adquirido de novo a partir de um progenitor portador balanceado
O seu diagnóstico pode ser feito ainda intra-útero, no período pré-natal, sendo indicada uma investigação genética no material fetal quando a idade da mãe for superior a 35 anos, alteração nos exames ultrassonográficos (translucência nucal alterada, ausência do osso nasal e outras malformações).
O diagnóstico, após o nascimento, é realizado através do quadro clínico do recém-nascido e do estudo genético.
Características:
- Baixo peso ao nascimento, com choro fraco; hipotonia seguida de hipertonía, hipoplasia da musculatura esquelética e do tecido adiposo subcutá- neo; diminuição de resposta a estímulos sonoro.
- Hipertonia (característica típica);
- Estatura baixa;
- Cabeça pequena, alongada e estreita;
- Zona occipital muito saliente;
- Pescoço curto com excesso de pele;
- Orelhas baixas e mal formadas;
- Defeitos oculares;
- Palato alto e estreito, por vezes fendido;
- Lábio leporino;
- Maxilares recuados;
- Esterno curto;
- Mão cerrada segundo uma forma característica (2º e 5º dedos sobrepostos, respectivamente, aos 3º e 4º dedos);
- Pés virados para fora e com calcanhar saliente, com as plantas arqueadas;
- Rugas presentes na palma da mão e do pé, ficando arqueadas nos dedos;
- Unhas geralmente hipoplásticas e atrofiadas;
- Acentuada má formação cardíaca (a comunicação interventricular e a persistência do canal arterial são as mais freqüentes);
- Anomalias renais (rim em ferradura, tecido pancreático heterotópico, eventração diafragmática, diveitículo de Meckel e diversos outros tipos de displasias renais são observados freqüentemente);
- Anomalias do aparelho reprodutor;
- Pescoço curto com excesso de pele;
- Mamilos pequenos, consideravelmente distantes;
- Órgãos genitais externos aparecem com uma constituição anormal (é comum criptorquidia nos meninos e hipertrofia de clitoris com hipoplasia dos grandes lábios nas meninas);
- Presença de hérnia inguinal ou umbilical, e/ou diastase dos músculos retos; pelvis estreita, limitação da abdução dos quadris.
- Deficiência mental Cerca de 30% dos portadores da Síndrome de Edwards demonstram algum comprometimento do sistema nervoso central, sendo os mais freqüentes: alteração do padrão dos giros cerebrais, alterações morfológicas cerebelares, mielomeningoceli, anomalias do corpo caloso e hidrocefalia. Os pacientes apresentam, normalmente, atrofia cerebral de graus variados, demonstrada na tomografia axial computadorizada de crânio.
vídeo relacionado
Síndrome de Turner
Cariótipo:
Tratamento:
Síndrome de Turner
Cariótipo:
A Síndrome de Turner, descrita na década de 40, é característica do sexo feminino e ocorre numa proporção de 1:2500 a 1:5000 nascimentos vivos.
A Síndrome de Turner é identificada no momento do nascimento, ou antes da puberdade por suas características fenotípicas distintivas. Em geral resulta de uma não-disjunção durante a formação do espermatozóide. A constituição cromossômica mais frequente é 45, X (monossomia do cromossomo X), não apresentando, portanto, cromatina sexual. O erro na formação do gameta costuma ser paterno, em até 80%. Contudo, 50% dos casos possuem outros cariótipos, sendo o mosaicismo 45, X / 46, XX é responsável por 25% dos casos. A idade dos pais das meninas com Síndrome de Turner não parece ter qualquer importância e não foram identificados fatores hereditários. Não parece haver qualquer providência que os pais possam tomar para evitar que uma de suas filhas tenha Síndrome de Turner.
Muitas dessas concepções terminam em aborto; a expectativa de vida nesta síndrome era menor que a da população geral, sendo de menos 13 anos no primeiro ano de vida e de menos 10 anos quando estas pacientes atingiam a idade de 40 anos.
A portadora apresenta baixa estatura, órgãos sexuais (ovários e vagina) e caracteres sexuais secundários (seios) poucos desenvolvidos (por falta de hormônios sexuais), tórax largo em barril, pescoço alado (com pregas cutâneas bilaterais), má-formação das orelhas, maior frequência de problemas renais e cardiovasculares, e é quase sempre estéril (os ovários não produzem óvulos).
O diagnóstico pode ser feito em qualquer idade; cerca de 30% das crianças são diagnosticadas ao nascimento e outras 25,5% durante o período médio da infância. Para muitas meninas portadoras de Síndrome de Turner, entretanto, o diagnóstico pode ser feito somente na adolescência. O médico pode indicar tratamento hormonal a partir da puberdade. Por causa de um possível amadurecimento mental inicial um pouco lento, deve ser estimulada desde cedo em casa e na escola.
As primeiras observações realizadas com indivíduos severamente afetados associavam a síndrome de Turner algum grau de deficiência mental. Posteriormente ficou evidente que estas pacientes têm um desenvolvimento cognitivo alterado apenas qualitativamente, pois elas possuem uma inteligência verbal superior à das mulheres normais, compensando, assim, as suas deficiências quanto à percepção forma-espaço.
Disto resulta que o nível intelectual global das Turner é igual ou, mesmo, levemente superior ao da população feminina normal.
Por outro lado, não exibem desvios de personalidade, o que significa, inclusive, que sua identificação psicossexual não é afetada.
As anomalias congênitas mais prevalentes são os estigmas diversos (palato em ogiva, cúbito valgo, epicanto e outros). As doenças cardíacas (principalmente as lesões do "coração esquerdo") e as renais (duplicidade do sistema coletor, rotação dos rins), ocorrem em cerca de 40% das pacientes. É descrita também uma alta incidência de outras doenças, como otite média, hipertensão, resistência insulínica, hipercolesterolemia, endocardite e doenças autoimunes, entre elas o hipotireoidismo, doença celíaca e o vitiligo.
Disto resulta que o nível intelectual global das Turner é igual ou, mesmo, levemente superior ao da população feminina normal.
Por outro lado, não exibem desvios de personalidade, o que significa, inclusive, que sua identificação psicossexual não é afetada.
As anomalias congênitas mais prevalentes são os estigmas diversos (palato em ogiva, cúbito valgo, epicanto e outros). As doenças cardíacas (principalmente as lesões do "coração esquerdo") e as renais (duplicidade do sistema coletor, rotação dos rins), ocorrem em cerca de 40% das pacientes. É descrita também uma alta incidência de outras doenças, como otite média, hipertensão, resistência insulínica, hipercolesterolemia, endocardite e doenças autoimunes, entre elas o hipotireoidismo, doença celíaca e o vitiligo.
Ocorrem problemas pela falta de tratamento. O hipogonadismo levaria ao envelhecimento precoce, osteoporose e risco de doença cardiovascular provocada pela falta da proteção estrogênica, a baixa estatura e a má qualidade de vida.
Quanto ao envelhecimento, são poucos os relatos do envelhecer na Síndrome de Turner, conseqüente à maior incidência de doenças cardiovasculares, hipertensão, diabetes e fraturas, embora os riscos aumentados de fraturas seriam semelhantes para qualquer faixa etária.
Características das portadoras:
As meninas com Turner podem apresentar traços físicos que não são característicos desta condição física. Algumas meninas podem não apresentar nenhum, e outras podem ter alguns ou muitos destes traços. Ao nascimento, entre um terço e metade das meninas com Turner apresentará inchaços com aspecto de um coxim no dorso das mãos e pés. Isto normalmente desaparece após certo tempo, porém pode reaparecer durante a puberdade. Algumas meninas com Turner podem ter um palato (céu da boca) estreito e elevado e um maxilar inferior menor, o que pode levar à dificuldade na alimentação como um refluxo. Estas dificuldades geralmente podem ser resolvidas ou minimizadas através do aconselhamento de seu médico. Problemas dentários ocasionalmente podem ocorrer numa época posterior.
As unhas frequentemente se dobram em relação aos dedos e artelhos de um modo característico, e têm uma tendência a "enganchar" nas meias. Muitas meninas com Turner apresentam um número maior que o habitual de manchas escuras , frequentemente na face. Outro aspecto mais raro da Síndrome de Turner é o pescoço com um septo lateral. Este é uma pequena dobra de pele de cada lado do pescoço dando a impressão que o pescoço é curto. O paciente pode, com a aprovação de seu médico, remover esta pequena dobra de pele com um cirurgião plástico que tenha particular experiência com Síndrome de Turner.
Altura (estatura reduzida. Ao nascimento, estas meninas geralmente têm um comprimento menor e pesam menos que as outras. Durante os primeiros anos de suas vidas, elas crescem quase tão rápido quanto suas contemporâneas, porém, com o tempo, a diferença na altura torna-se mais aparente. A diferença é particularmente notável quando as outras meninas entram na puberdade e apresentam rápidos aumentos de estatura, o que não ocorre com as meninas com Turner. Geralmente as mulheres com Turner que não estão recebendo tratamento são, em média, 20 cm mais baixas que outras mulheres. Nos últimos anos, as meninas com Turner estão sendo tratadas com hormônio de crescimento e os resultados provisórios sugerem que a estatura final possa ser aumentada de 5 a 10 cm);
Desenvolvimento puberal e menstruação (Para a maioria das meninas com Turner, os ovários não se desenvolvem como deveriam. As meninas com Turner, antes do nascimento, possuem um número normal de folículos ovulares em seus ovários. Entretanto, estes folículos desaparecem rapidamente e as meninas com Turner geralmente não mais os possuem ao nascimento. Quando ocorre ausência dos folículos ovulares, também há uma ausência dos hormônios sexuais femininos, as quais são importantes para o desenvolvimento dos caracteres sexuais secundários (pelos pubianos, desenvolvimento dos seios, etc.). Consequentemente, muitas meninas com Turner podem ter desenvolvimento incompleto das características sexuais secundárias. A maioria das meninas com Turner não menstrua e apenas podem ter filhos em raros casos). Em decorrência da disgenesia ovariana, a única fonte de estrógenos para essas pessoas são as supra-renais; como a taxa desses hormônios é baixa, as pacientes devem receber aplicações de estrógenos para estimular o desenvolvimento dos caracteres sexuais secundários e o aparecimento da menstruação. Usualmente esse tratamento tem início aos 16 anos para evitar que os estrógenos aplicados retardem ainda mais o crescimento.
O retardo mental ocorre em raros casos, mas muitas meninas com síndrome de Turner apresentam dificuldade para orientar-se espacialmente, e tendem a apresentar uma má pontuação em testes que exigem destreza e cálculo, embora em testes de inteligência verbal sejam normais ou superiores ao normal
Anormalidades cardíacas
Problemas de ouvido com tendência para frequentes infecções no ouvido médio. Com o correr do tempo, algumas mulheres com Turner podem apresentar um comprometimento da audição.
Problemas de alimentação na infância (como regurgitação e ocasionalmente vômitos);
Doenças renais crônicas (aproximadamente um terço das crianças com doença renal crônica têm crescimento anormal, em parte devido ao fato de as doenças renais perturbarem o metabolismo do hormônio de crescimento (GH). Os hormônios corticosteróides, que são frequentemente utilizados para tratar a doença renal, podem também retardar o crescimento).
O tratamento geralmente envolve a administração de hormônio de crescimento humano (hGH) isolado ou associado a baixas doses de estrógeno e ou um esteróide anabólico.
O Hormônio do crescimento continua a desempenhar um importante papel na fase adulta, regulando o metabolismo e composições do corpo, promovendo ossos fortalecidos e um coração saudável e melhorando a qualidade de vida das pessoas.
O excesso de peles no pescoço pode ser corrigido através de cirurgia plástica, que devolvem a aparência normal a região.
O acompanhamento psicológico pode ser importante, pois apesar de ter um desenvolvimento mental um pouco mais lento, as portadoras dessa síndrome tem um bom potencial de aprendizagem e devem ingressar na escola normalmente.

















Muito interessante, me ajudou num trabalho escolar,Obrigado!!.
ResponderExcluirMuito bom! Lembrando Que a Sindrome de Tuner também foi intuitada em Kyaguaran - CHINA onde aprofundamentos genéticos e estudos estruturais nas formações genéticas foram prontamente relacionados ao modo de vida e compromentimento sócio-mental dos pais. Esse estudo foi indicado ao prêmio NOBEL de medicina e presenciei pessoalmente quando estive lá.
ResponderExcluir